HOMEWORK – Gliederungsübersicht
1)
Beobachtung
und Auswertung von Redoxreaktionen anhand von Videos
Hier werden 2 YouTube-Videos vorgestellt und besprochen. Die beiden
Reaktionen, die hier das Thema sind, werden bei 2) als Beispiele zum Ausgleich
von Redoxgleichungen besprochen:
Der „Ammoniumdichromat-Vulkan“
– Vorstellung des Stoffs, Oxidationszahlen
– Beobachtungen
– Energiephänomene, Oxidationsstufen von Chrom und Stickstoff
– Warum dieser früher sehr beliebte Schulversuch jetzt im Unterricht untersagt
ist.
Die Reaktion von Kupfer mit Salpetersäure
– Vorbemerkungen
– Beobachtungen, Oxidationszahlen
– Folgereaktionen
2)
Die
ausgeglichene Redoxgleichung
a) „Vorwort“
b) Buchseiten „Methoden“ zum Thema
c) Das Ausgleichsverfahren: · Worin besteht der Bezug zur Realität? ·
Methode.
d) Übungsgleichungen
e) Lösungen zu d)
BEOBACHTUNG VON
REDOXREAKTIONEN
Der Ammoniumdichromatvulkan
Vorstellung des Stoffs Ammoniumdichromat
 (NH4)2Cr2O7
der kristalline Reinstoff (für den Vulkan)
(NH4)2Cr2O7
der kristalline Reinstoff (für den Vulkan)
 Die Lösung in Wasser: (NH4)2Cr2O7
Die Lösung in Wasser: (NH4)2Cr2O7
![]() 2 NH4+aq + Cr2O72–aq
2 NH4+aq + Cr2O72–aq
Der Stickstoff im Ammoniumion
liegt wie im Ammoniak in der Oxidationsstufe –III vor:
N(–III)H(+I)4+
Das Chrom im Dichromat ist in der
Oxidationsstufe +IV: Cr(+VI)2O(–II)22–
Beobachtung des
Vulkanversuchs
https://www.youtube.com/watch?v=oWpXPSBSe6M Kurzvideo (48 sec)
https://www.youtube.com/watch?v=OIi0kA9lpqk Showvideo (russische Chemie-Freaks)
Eine kleinere Menge Ammoniumdichromat wird in einer Porcellanschale zu einem kleine Hügel aufgeschüttet.
https://www.youtube.com/watch?v=oWpXPSBSe6M&t=06s Zufuhr von Aktivierungsenergie
https://www.youtube.com/watch?v=oWpXPSBSe6M&t=20s Dunkelgrünes fein verteiltes Chrom(III)oxid ist entstanden und verteilt sich ringsum. Die Reaktion ist stark exotherm (Funkenflug) und liefert die Aktivierungsenergie für restliche Stoffmenge. In der Mitte ist die Hitze- und Gasentwicklung am stärksten und reißt die Chromoxid-Flocken nach oben („Ascheregen“).

https://www.youtube.com/watch?v=oWpXPSBSe6M&t=42s Der erloschene Vulkan. Der große Volumenzuwachs beim grünen Chromoxid ergibt sich aus der Blähwirkung der bei der Zerfallsreaktion freigesetzten Gase:
–II +I
+VI –II +III –II +I –II 0
![]()
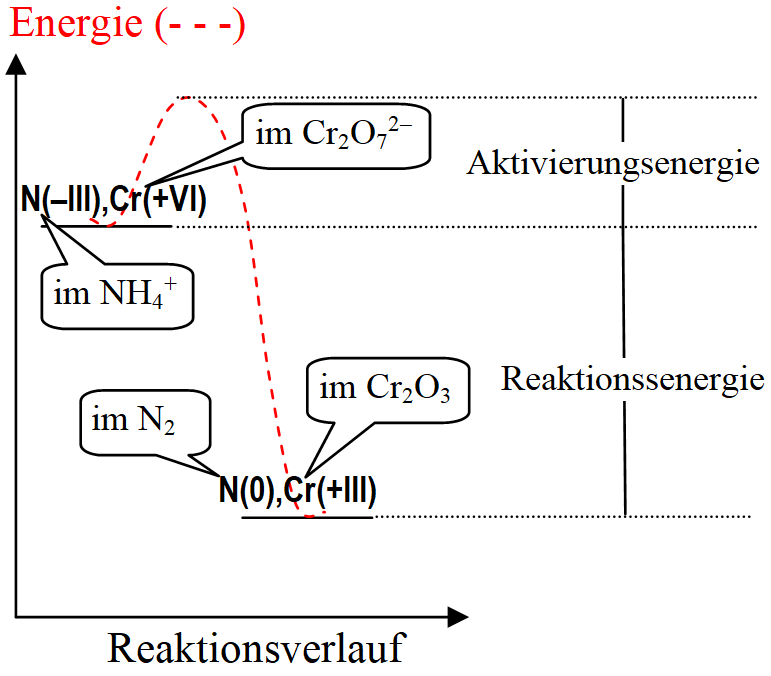
Energetik der
Vulkan-Reaktion
|
|
Erklärungen zum energetischen Verlauf: Die Edukte haben einen höheren Energie-inhalt als die Produkte, deswegen setzt die Reaktion Energie frei, die Reaktion ist stark exotherm. Die Oxidationsstufen N(0) im N2 und Cr(+III) im Cr2O3 sind besonders stabil, es gibt ein großes Bestreben, diese Zustände zu erreichen, das treibt die Reaktion an. Ammoniumdichromat ist eine metastabile Verbindung, d.h. nur die Aktivierungs-energie verhindert, dass dieser energiespei-chernde Stoff spontan zerfällt. Allerdings ist Ammoniumdichromat auch ein Explosiv-stoff, der durch Schlag zur Detonation ge-bracht werden kann. |
|
Warum der Vulkan-Versuch in Schulen verboten wurde |
|
|
|
|
|
|
Wenn man die Gefahrstoffsymbole
ansieht, (weißt du,
was diese im Einzelnen bedeuten?) verwundert das Verbot nicht. Die Produkte der Reaktion sind zwar beide harmlos, aber der Ascheregen reißt unzersetztes Ammoni-umdichromat mit, das mit dem Chromoxid vermengt ist; auch gefährliche Staubteilchen können verweht werden. Nur, wenn man den Versuch sehr sorgfältig durchführt und sich aller Gefahren bewusst ist, ist das Experiment ungefährlich. Chromate sind gefährliche Krebs-
und Aller-gieauslöser!! |
Die Reaktion von Kupfer mit Salpetersäure
Vorbemerkungen
Im
Unterricht haben wir den Versuch „Kupfer + Salzsäure“ angesehen, wo aber keine
Reaktion stattfand: Kupfer ist als Edelmetall ein schwacher Elektronendonator
(schwaches Reduktionsmittel) und die Oxidationskraft der Säure (HCl bzw. H+,
H3O+) reicht nicht aus Kupfer zu oxidieren. Anders bei
der Salpetersäure, HNO3, welche als „oxidierende Säure“ bezeichnet
wird. Ihr viel stärkeres Oxidationsvermögen steckt im Säurerest Nitrat.
H(+I)N(+V)O(–II)3. N(+V) ist ein starker
Elektronenakzeptor.
Beobachtungen…
Der
Internet-Link zum Video
https://www.youtube.com/watch?v=MPRTgdJvKEs
0:00 – 0:21 65% Salpetersäure wird vorgelegt, Kupfer in Drahtform hinzugegeben
0:21 – 0:33 Die Redoxreaktion läuft und produziert Mengen an braunen Dämpfen

0:44 – 2:00 Ein Behälter mit Wasser wird angeschlossen (rechts). Weil die „Nitrosen Gase“ (NOx = NO/NO2-Gemisch) entstehen.
Folgereaktionen
Da die nitrosen Gase mit Wasser reagieren, entsteht im Kolben links ein Vakuum. Die Stickstoffoxide bilden mit Wasser zusammen Salpetersäure. (Vergleiche Übungsgleichungen)
ca.: 1:19 Die Nitrosen Gase sind weitgehend infolge der Reaktion verschwunden. Die blaue Lösung enthält Kupfernitrat: (rechts in Wasser gelöster Zustand des Kupfersalzes)
![]()
 Ein kleiner Rest der nitrosen Gase verbleibt
über der Lösung.
Ein kleiner Rest der nitrosen Gase verbleibt
über der Lösung.
Die blaue Farbe ist für alle Cu(+II)-Verbindungen charakteristisch, Kupfer(II)nitrat, Kupfer(II)sulfat, usw.
DIE AUSGEGLICHENE REDOXGLEICHUNG
a) Vorwort
Wir haben das damals über ein halbes Jahr lang „exerziert“, bis es auch der Letzte (nicht) konnte.
Warum wir das machen mussten, wurde uns nach diesem Motto erklärt:

Der wahre Grund ist derselbe, warum der Mensch auf Berge steigt. Man kann es sich, dem Lehrer, der Welt zeigen, dass man’s drauf hat: man muss wissen wo’s lang geht, die Realität im Auge behalten (keinem Höhenrausch verfallen), konsequent sein, immer wieder kontrollieren, ob man noch auf der richtigen Route ist, sich im Klaren sein, dass Fehler in den Abgrund führen. Übrigens: METHODE heißt übersetzt ERFOLGSWEG, ROUTE
Nicht jeder ist zum Gipfelstürmer geboren… Aber: dem Mutigen gehört die Welt!
b) Die Buchseiten – bitte gründlich studieren


c) Das Ausgleichsverfahren
· Worin besteht der Bezug der Ausgleichsmethode zur Realität? Ein Beispiel…
Betrachte die folgende Oxidation (e–-Abgabe) von Kupfer zu Kupfer(II)ionen: Cu ® Cu2+ + 2e–
Hier braucht’s keine Ausgleichsmethode, da passt schon alles: ausgeglichene Ladungen, auf beiden Seiten Ladungssumme = 0, die Atomzahl, auf beiden Seiten genau ein Kupferatom, und die 2e– gehen dann an einen Elektronenakzepter, der reduziert wird. Aber das angekündigte Beispiel kommt jetzt.
0 +II –II
Die Oxidation von Kupfer zu Kupfer(II)oxid: Cu ® CuO + 2e– die OZ zeigt an, dass 2 e– abgegeben wurden
Hier müssen Ladungen und Atomzahl noch ausgeglichen werden, zur Bildung von CuO fehlt das Oxid O(–II)
=> Cu + O2– ® CuO + 2e– jetzt passt wieder alles! Aber so ist es nicht realistisch, da Oxidionen so stark basisch sind, dass sie in Wasser nicht existieren, sondern sich in OH– umsetzen O2– + H2O ® 2 OH–; daher ist der Ausgleich mit Hydroxidionen zu formulieren
=> Cu + 2 OH–
®
CuO + 2e–
+ H2O (OH– macht den Ladungsausgleich)
(Wasser macht den Atomausgleich)
Man sagt: „du musst die 2 OH– auf die linke Seite hinschreiben, damit die Elektronenladungen rechts ausgeglichen sind“. Die Hydroxidionen reagieren tatsächlich als Edukte, sie werden nicht nur „hingeschrieben“, damit’s passt. Achtung! In saurer Lösung existiert praktisch kein OH–, es muss mit H3O+ ausgeglichen werden!!
· Ein vollständig besprochenes Beispiel: Die Reaktion von Kupfer mit Schwefelsäure
https://www.youtube.com/watch?v=exGTLTIpdbo (lieber ohne Ton)
Beobachtungen: An der Kupferoberfläche bildet sich schwarzes Kupfer(II)oxid. Gasentwicklung: SO2-Gas entsteht.
Eine bläuliche Farbe tritt auf (das passiert aufgrund einer Folgereaktion)
Schwefelsäure + Kupfer ® Kupfer(II)oxid + Schwefeldioxid (Wortgleichung)
+I+VI-II 0 +II–II +IV–II
H2SO4 + Cu ® CuO + SO2 (die Rohgleichung, „behelfsmäßig“ formuliert)
Die OZ sagen dir, dass Kupfer Cu(0) zum Cu(+II) im CuO oxidiert wird (positivere OZ, e–-Abgabe) und dass
das Schwefelatom der Säure zum S im SO2 reduziert wurde (negativere OZ, e–-Aufnahme).
Das folgende Ausgleichsverfahren ist mit der Methode im Buch (rechte Seite oben, Redoxreaktion im Sauren) zu vergleichen. Es ist aber dringend zu empfehlen die Schritte 2a, 3a, 4a, 5a in einer Zeile, und ebenso 2b, 3b, 4b, 5b in einer Zeile zu schreiben, sonst gibt’s nur unnötige Übertragungsfehler…
Oxidation:
Cu + 3 H2O ® CuO + 2 e– + 2 H3O+ Oxidationszahlen stören hier nur!!! Siehe „Behelf“ oben
schwarz: was die Rohgleichung vorgibt Die OZ
aus der Rohgleichung sagen: 2 e– werden abgegeben
grün:
die abgegebenen e– müssen auf die rechte Seite geschrieben werden
rot:
saure Lösung (Schwefelsäure!), => H3O+-Ladungsausgleich;
Ladungssumme auf beiden Seiten = 0, passt
blau:
fehlt nur noch der Atomausgleich (Stoffausgleich) mit H2O
Kontrollieren, ob wirklich alles passt (denke an die Bergtour)
Reduktion: die Reihenfolge ist wieder schwarz, grün, rot, blau
H2SO4 +
2 e– + 2 H3O+ ® SO2 + 4 H2O passt ja tatsächlich
alles.
Wenn
man mit H2O nicht ausgleichen könnte, hieße das, dass etwas faul
ist. JEDE Redoxgleichung geht auf.
Addition
zur fertigen Redoxgleichung: erstmal alles
zusammenschreiben…
Cu + H2SO4 + 2 e– + 2 H3O+ + 3 H2O ® CuO + 2 e– + 2 H3O+ + SO2 + 4 H2O | –2e–, –3H2O, –3H3O+
…
dann von Überflüssigem bereinigen => die Elektronen müssen immer
weggestrichen werden können.
Cu + H2SO4 ® CuO + SO2 + H2O
Da
wäre man aber auch einfacher draufgekommen, wieso die Umstände? Die Antwort
lautet, dass die Redoxchemie hauptsächlich mit den
Halbreaktionen arbeitet. Jede Oxidationshalbreaktion ist zumindest theoretisch
mit jeder Reduktionshalbreaktion kombinierbar. Die Halbreaktionen sind also wie
Elemente, die beliebig kombinierbar sind: sehr praktisch
d) ÜBUNGSGLEICHUNGEN
d1)
Übungsgleichungen mit Stickstoffverbindungen. Stickstoff ist ein redoxchemisch sehr aktives Element, das sehr vielen
verschiedenen Oxidationsstufen vorkommt.
ð Welche OZ von N liegt jeweils in folgenden
Molekülen/Verbindungen vor: NH3, N2, N2O, HNO2
(Salpetrige Säure), NO, NO2, HNO3, N3–
(Nitrid), NO2– (Nitrit), NO3–
(Nitrat)
ð Reaktionsgleichungen bei der Bildung von Salpetersäure aus
Nitrosen Gasen: Stelle Reaktionsgleichungen auf; welche Verbindungen werden
oxidiert bzw. reduziert, welches sind jeweils Elektronendonatoren (Red.mittel) und Elektronenakzeptoren (Ox.mittel)
– Stickstoffmonoxid reagiert mit Luftsauerstoff zu Stickstoffdioxid
– Stickstoffmonoxid reagiert mit Stickstoffdioxid und Wasser zu Salpetriger
Säure
– Salpetrige Säure und Luftsauerstoff reagieren zu Salpetersäure
(bzw. Nitrit reagiert mit
Luftsauerstoff zu Nitrat)
– Nitrat reagiert mit Schwefelsäure zu Salpetersäure
– Stickstoffdioxid reagiert mit Luftsauerstoff und Wasser zu Salpetersäure
d2)
Variante zu einer im Buch erklärten Reaktion. Auf der rechten Buchseite findet
sich bei „Redoxreaktionen im basischen
Milieu“ das Beispiel „Wasserstoffperoxid
reagiert mit Permanganationen zu Braunstein (MnO2)
und Sauerstoff“. Dazu gibt es zwei Varianten:
:
|
Zu diesen beiden Reaktionen die Redoxgleichung
(mit Ausgleich) formulieren! |
|
|
Variante 1 |
Variante 2 |
|
Wasserstoffperoxid reagiert im schwach sauren Milieu mit Permanganationen zu Braunstein (MnO2) und
Sauerstoff |
Wasserstoffperoxid reagiert im stark sauren Milieu mit Permanganationen zu Mangan(II)ionen
und Sauerstoff |
|
Bitte
die unter c) beschriebene Methode anwenden; für den Ausgleich beachten, dass
die Reaktionen im sauren Milieu stattfinden. Die Mangan(II)ionen finden sich auch in einem Buchbeispiel. |
|
d3)
Weitere Übungen folgen …